(人民日报健康客户端记者 赵萌萌)据人民日报健康客户端不完全统计,2023年第一季度国家药品监督管理局共批准了30多款新药(包括新适应症,不含生物类似药、中药和疫苗),主要聚焦在肿瘤、贫血、银屑病、新型冠状病毒感染等多个领域。
在这些获批的新药中,以肿瘤适应症最多,其次是感染和自身免疫性疾病。其中,多款新药为首次在中国获批,包括CDK4/6、BTK、MET等靶向抑制剂。
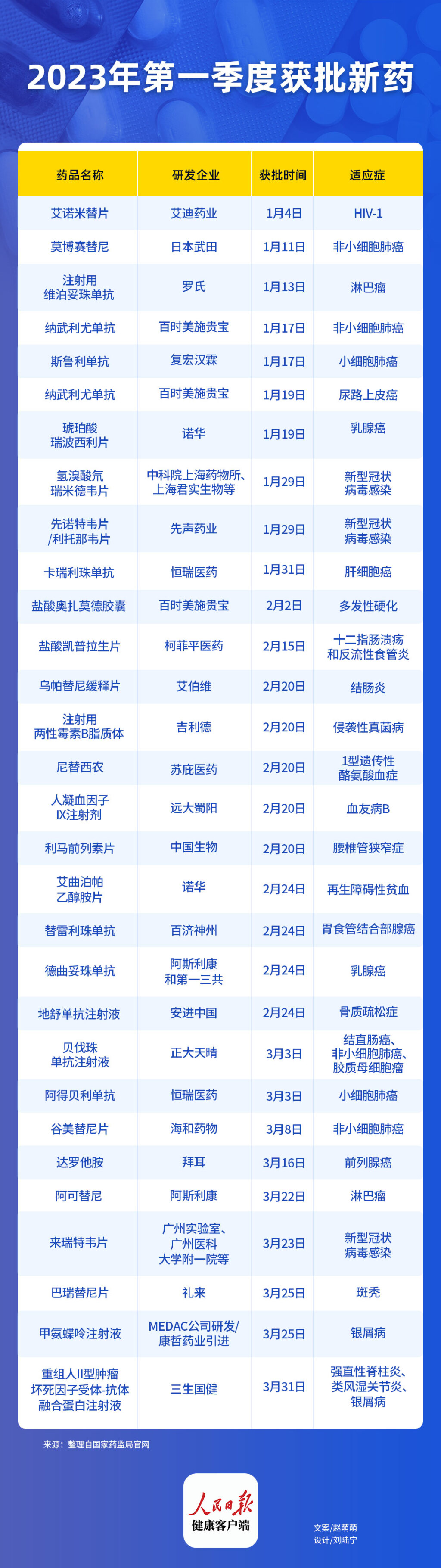
药品名称:艾诺米替片
研发企业:艾迪药业
适应症:HIV-1
获批时间:1月4日
1月4日,江苏艾迪药业1类新药,艾诺米替片(商品名:复邦德)获批上市,用于治疗成人HIV-1感染初治患者。艾诺米替片是由艾诺韦林、拉米夫定和富马酸替诺福韦二吡呋酯组成的复方制剂,开发代号ACC008。
该药是2023年第一款获药监局批准上市的新药,同时也是国内第一个具有自主知识产权的三联单片复方制剂。该药品的上市,为成人HIV-1感染患者提供了新的治疗选择。
药品名称:纳武利尤单抗
研发企业:百时美施贵宝
适应症:非小细胞肺癌
获批时间:1月11日
1月11日,国家药监局发布公告,通过优先审评审批程序附条件批准武田制药申报的1类创新药琥珀酸莫博赛替尼胶囊上市。该药适用于含铂化疗期间或之后进展且携带表皮生长因子受体20号外显子插入突变的局部晚期或转移性非小细胞肺癌成人患者。
莫博赛替尼是全球首款治疗EGFR 20号外显子插入突变晚期非小细胞肺癌的口服靶向药物,其获批标志着EGFR 20号外显子插入突变晚期非小细胞肺癌治疗史上二十年来的重大突破,宣告针对这一疾病的治疗在中国进入靶向治疗新纪元。
药品名称:注射用维泊妥珠单抗
研发企业:罗氏
适应症:淋巴瘤
获批时间:1月13日
1月13日,罗氏制药中国宣布,该公司靶向CD79b的抗体偶联药物注射用维泊妥珠单抗获国家药监局批准两项适应症,分别为:联合利妥昔单抗、环磷酰胺、多柔比星和泼尼松,适用于治疗既往未经治疗的弥漫性大B细胞淋巴瘤(DLBCL)成人患者;联合苯达莫司汀和利妥昔单抗,用于不适合接受造血干细胞移植的复发或难治性DLBCL成人患者。
维博妥珠单抗是一款靶向CD79b的“first-in-class”ADC产品,已在全球多个国家和地区获批。
药品名称:纳武利尤单抗
研发企业:百时美施贵宝
适应症:非小细胞肺癌
获批时间:1月17日
1月17日,国家药品监督管理局批准纳武利尤单抗(商品名:欧狄沃)新适应症,联合铂类双药化疗,作为可切除的非小细胞肺癌成年患者的新辅助治疗方案,无论患者的PD-L1表达情况如何。
欧狄沃联合化疗是中国首个且目前唯一获批用于NSCLC新辅助治疗的免疫肿瘤疗法。在此之前,以欧狄沃为基础的免疫治疗目前在中国已获批8项适应症。
药品名称:斯鲁利单抗
研发企业:复宏汉霖
适应症:小细胞肺癌
获批时间:1月17日
1月17日,国家药监局官网公示,国产PD-1抑制剂斯鲁利单抗(商品名:汉斯状)新适应症获批,联合化疗一线治疗广泛期小细胞肺癌。
值得一提的是,这是汉斯状在中国获批的第3项适应症,也是首款获批用于小细胞肺癌的国研PD-1!
药品名称:纳武利尤单抗
研发企业:百时美施贵宝
适应症:尿路上皮癌
获批时间:1月19日
1月19日,百时美施贵宝宣布,纳武利尤单抗注射液(商品名:欧狄沃)获国家药品监督管理局批准,单药用于接受根治性切除术后伴有高复发风险的尿路上皮癌患者的辅助治疗。
伴随此次获批,欧狄沃成为中国首个获批用于尿路上皮癌辅助治疗的PD-1抑制剂。至此,在早期癌症的治疗方面,欧狄沃是目前唯一在华获批两个辅助治疗适应症的PD-1/PD-L1抑制剂。
药品名称:琥珀酸瑞波西利片
研发企业:诺华
适应症:乳腺癌
获批时间:1月19日
1月19日,诺华(中国)宣布,其乳腺癌治疗产品琥珀酸瑞波西利片 (商品名:凯丽隆)获国家药品监督管理局批准,与芳香化酶抑制剂联合用药,作为激素受体阳性、人表皮生长因子受体2阴性局部晚期或转移性乳腺癌绝经前或围绝经期女性患者的初始内分泌治疗,使用内分泌疗法治疗时应联用黄体生成素释放激素激动剂。
作为目前国内唯一获批晚期一线绝经前适应症的CDK4/6抑制剂,凯丽隆将为中国绝经前和围绝经期HR+/HER2-晚期乳腺癌患者提供一种新的治疗选择。
药品名称:氢溴酸氘瑞米德韦片
研发企业:中科院上海药物所、上海君实生物等联合开发
适应症:新型冠状病毒感染
获批时间:1月29日
1月29日,国家药品监督管理局按照特别审批程序,进行应急审评审批,附条件批准上海旺实生物医药科技有限公司申报的新型口服核苷类抗新型冠状病毒药物民得维(氢溴酸氘瑞米德韦片,VV116)上市。该药物为口服小分子新冠病毒感染治疗药物,用于治疗轻中度新型冠状病毒感染(COVID-19)的成年患者。
这款由上海市自主研发的1类国产创新药由中科院上海药物所、上海君实生物等联合研发,上海旺实生物医药科技有限公司持有,由上海迪赛诺生物医药有限公司作受托生产。
药品名称:先诺特韦片/利托那韦片
研发企业:先声药业
适应症:新型冠状病毒感染
获批时间:1月29日
1月29日,国家药监局附条件批准先声药业先诺欣(先诺特韦片/利托那韦片组合包装),用于治疗轻至中度新型冠状病毒感染成人患者。
先诺欣是一款口服小分子抗新冠病毒创新药,其中先诺特韦针对SARS-CoV-2病毒复制必须的3CL蛋白酶,与低剂量利托那韦联用有助于减缓先诺特韦在体内的代谢或分解,提高抗病毒效果。此外,先诺欣复方中的利托那韦将由歌礼制药供应。
药品名称:卡瑞利珠单抗
研发企业:恒瑞医药
适应症:肝细胞癌
获批时间:1月31日
1月19日,国家药品监督管理局官网最新公示,恒瑞医药抗PD-1单抗注射用卡瑞利珠单抗新适应症上市申请已获得批准,联合阿帕替尼(艾坦 )用于晚期肝细胞癌一线治疗。
这是卡瑞利珠单抗在中国获批的第9项适应症,也是中国首个获批的用于治疗晚期肝细胞癌的PD-1抑制剂与小分子抗血管生成药物组合,为晚期肝癌患者带来用药新选择。
药品名称:盐酸奥扎莫德胶囊
研发企业:百时美施贵宝
适应症:多发性硬化
获批时间:2月2日
2月2日,百时美施贵宝公司宣布,该公司的新型选择性鞘氨醇1-磷酸受体调节剂盐酸奥扎莫德胶囊获得国家药品监督管理局批准,用于治疗成人复发型多发性硬化,包括临床孤立综合征、复发-缓解型多发性硬化和活动性继发进展型多发性硬化。
这是百时美施贵宝中国在自身免疫疾病领域首个获批的创新疗法,有望为中国多发性硬化患者带来“躯体+认知”双重保护治疗新方案。
药品名称:盐酸凯普拉生片
研发企业:柯菲平医药
适应症:十二指肠溃疡和反流性食管炎
获批时间:2月15日
2月15日,由复星医药独家商业化的首款国产自主研发的钾离子竞争性酸阻滞剂盐酸凯普拉生片(商品名:倍稳)获得国家药品监督管理局批准,用于十二指肠溃疡和反流性食管炎的治疗。
盐酸凯普拉生片为柯菲平医药自主研发的1类创新药。2022年9月,复星医药与柯菲平医药达成全球合作,双方将联合开发并由复星医药独家商业化。
药品名称:乌帕替尼缓释片
研发企业:艾伯维
适应症:结肠炎
获批时间:2月20日
2月20日,艾伯维宣布,国家药品监督管理局已批准瑞福(乌帕替尼缓释片),用于治疗对一种或多种肿瘤坏死因子抑制剂应答不佳或不耐受或禁忌的中度至重度活动性溃疡性结肠炎成人患者。
这一批准是基于三项3期随机、双盲、安慰剂对照临床研究的有效性及安全性的数据支持,也是瑞福在胃肠病学领域中国获批的首个适应症。
药品名称:注射用两性霉素B 脂质体
研发企业:吉利德
适应症:侵袭性真菌病
获批时间:2月20日
2月20日,吉利德宣布,国家药品监督管理局已批准安必速(注射用两性霉素 B 脂质体)上市许可申请,用于治疗侵袭性真菌病。
安必速已在全球范围内广泛使用 30 年,其在国内的获批将为我国侵袭性真菌病患者提供一个新的经验性抗真菌治疗的一线选择。
药品名称:尼替西农
研发企业:苏庇医药
适应症:1型遗传性酪氨酸血症
获批时间:2月20日
2月20日,国家药监局官网显示,苏庇医药申报的尼替西农原研药已在中国获批上市。该药本次获批了口服混悬液和胶囊两个剂型,用于治疗成人和儿科患者的1型遗传性酪氨酸血症。
尼替西农由S wedish Orphan Biovitrum AB(SOBI)公 司开发,是国际上治疗1型酪氨酸血症(HT-1)的首选药物。
药品名称:人凝血因子IX注射剂
研发企业:远大蜀阳
适应症:血友病B
获批时间:2月20日
2月20日,远大蜀阳药业申报的人凝血因子IX上市申请已获得国家药品监督管理局批准。根据国家药监局药品审评中心优先审评公示,该药本次获批的适应症为:用于预防和治疗人凝血因子IX缺乏症(血友病B)导致的出血。
药品名称:利马前列素片
研发企业:中国生物
适应症:腰椎管狭窄症
获批时间:2月20日
2月20日,中国生物制药宣布用于镇痛和微循环领域治疗的利马前列素片(凯立通)获国家药监局批准上市,适应症为腰椎管狭窄症。
利马前列素片是目前临床唯一在说明书中明确适应症为腰椎管狭窄症治疗的小分子化药,是国内首个针对腰椎管狭窄症病理机制,兼具改善神经血流微循环障碍和改善神经功能的双重功效的药物,为腰椎管狭窄症全程管理的基础用药。
药品名称:艾曲泊帕乙醇胺片
研发企业:诺华
适应症:再生障碍性贫血
获批时间:2月24日
2月24日,国家药品监督管理局官网显示,诺华艾曲泊帕乙醇胺片(商品名:瑞弗兰)新适应症获批上市。用于既往对免疫抑制治疗缓解不充分的重型再生障碍性贫血患者。
2008年11月,该药获FDA批准上市,用于治疗既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性免疫性血小板减少症,成为全球首个针对该适应症的口服药物。
药品名称:替雷利珠单抗
研发企业:百济神州
适应症:胃食管结合部腺癌
获批时间:2月24日
2月24日,国家药品监督管理局官网显示,百济神州的PD-1抑制剂替雷利珠单抗(百泽安)的新适应症获得批准,用于一线治疗PD-L1阳性的晚期或转移性胃及胃食管结合部腺癌患者。
这也是替雷利珠单抗在中国获批的第10个适应症,此前这款药物已经获批用于治疗霍奇金淋巴瘤、尿路上皮癌等癌种的多类适应症,且其用于治疗实体瘤的关键性适应症的临床试验也已经在稳步推进。
药品名称:德曲妥珠单抗
研发企业:阿斯利康和第一三共
适应症:乳腺癌
获批时间:2月24日
2023年2月24日,阿斯利康和第一三共联合开发和商业化的注射用德曲妥珠单抗(商品名:优赫得)已获得国家药品监督管理局批准,用于治疗既往接受过一种或一种以上抗 HER2 药物治疗的不可切除或转移性 HER2 阳性成人乳腺癌患者。
优赫得是一款独特设计靶向HER2的抗体偶联药物。2022年4月12日,国家药品监督管理局药品审评中心将优赫得纳入突破性治疗品种名单,并于2022年4月24日将优赫得新药上市申请纳入优先审评。
药品名称:地舒单抗注射液
研发企业:安进中国
适应症:骨质疏松症
获批时间:2月24日
2月24日,安进中国宣布,普罗力(地舒单抗注射液)获得国家药品监督管理局批准,用于治疗骨折高风险的男性骨质疏松症,可帮助患者改善骨量,降低骨折发生的风险。
普罗力是目前中国首个且唯一用于治疗男性骨质疏松症的抗RANKL单抗类药物,此次获批将为更多中国患者带来安全有效的治疗新选择。
药品名称:贝伐珠单抗注射液
研发企业:正大天晴
适应症:结直肠癌、非小细胞肺癌、胶质母细胞瘤
获批时间:3月3日
3月3日,国家药品监督管理局官网显示,正大天晴药业贝伐珠单抗注射液(商品名:安倍斯)的上市申请获得批准。该产品被批准用于转移性结直肠癌,晚期、转移性或复发性非小细胞肺癌,复发性胶质母细胞瘤三大适应症的治疗。
此次获批是基于一项比较TQ-B2302(安倍斯)联合紫杉醇/卡铂与安维汀联合紫杉醇/卡铂一线治疗非鳞状非小细胞肺癌有效性和安全性的多中心、随机、双盲、平行对照Ⅲ期临床研究。研究显示,安倍斯联合紫杉醇/卡铂与安维汀联合紫杉醇/卡铂一线治疗非鳞状非小细胞肺癌有效性等效,安全性相似。。
药品名称:阿得贝利单抗
研发企业:恒瑞医药
适应症:小细胞肺癌
获批时间:3月3日
3月3日,国家药监局官网公示,恒瑞医药自主研发的抗PD-L1单抗阿得贝利单抗注射液获批上市,用于联合化疗一线治疗广泛期小细胞肺癌。
除了针对EC-SCLC,阿得贝利单抗还在其他的肺癌治疗领域探索,如由程颖教授牵头的用于局限期小细胞肺癌的3期临床试验、由广东省人民医院吴一龙教授牵头的针对可切除的II-III期非小细胞肺癌围手术期治疗的3期临床研究等均在进行中。
药品名称:谷美替尼片
研发企业:海和药物
适应症:非小细胞肺癌
获批时间:3月8日
3月8日,化药1类新药抗肿瘤MET抑制剂海益坦(谷美替尼片)通过国家药品监督管理局附条件批准上市,用于治疗具有间质-上皮转化因子外显子14跳跃突变的局部晚期或转移性非小细胞肺癌成人患者。
该药由中国科学院上海药物研究所与上海海和药物研究开发股份有限公司(海和药物)合作研发,由海和药物作为药品上市许可持有人。已于2021年9月被国家药品监督管理局纳入突破性治疗品种名单。
药品名称:达罗他胺
研发企业:拜耳
适应症:前列腺癌
获批时间:3月16日
3月16日,国家药监局官网显示,拜耳口服雄激素受体抑制剂达罗他胺新适应症上市申请获得批准,本次获批的适应症为联合多西他赛用于治疗转移性激素敏感性前列腺癌患者。
值得注意的是,达罗他胺还在不同阶段的前列腺癌中进行进一步研究,包括在mHSPC中进行的另一项III期试验(ARANOTE),以及评估达罗他胺在复发风险极高的局限性前列腺癌(DASL-HiCaP)中作为辅助性治疗的III期试验。
药品名称:阿可替尼
研发企业:阿斯利康
适应症:淋巴瘤
获批时间:3月22日
3月22日,国家药监局官网显示,由阿斯利康研发的BTK抑制剂阿可替尼胶囊中国获得上市批准,用于治疗既往至少接受过一种治疗的成人套细胞淋巴瘤患者。
阿可替尼是阿斯利康血液学管线中的核心产品之一,曾获得美国FDA授予优先审评资格、突破性疗法认定和孤儿药资格。
药品名称:来瑞特韦片
研发企业:广州实验室、广州医科大学附一院等
适应症:新型冠状病毒感染
获批时间:3月23日
3月23日,国家药监局公布新冠病毒感染治疗药物来瑞特韦片获批附条件上市,用于治疗新冠轻中症成年患者。
广州实验室研究员、广州呼研院副院长杨子峰介绍,在广州实验室的牵头组织下,广州医科大学附一院、广州呼研院、国家呼吸系统疾病临床医学研究中心等高效有序推进临床前及临床研究,广东众生睿创公司加紧协调产业转化,并得到三亚中心医院等全国科研和临床单位大力支持。
药品名称:巴瑞替尼片
研发企业:礼来
适应症:斑秃
获批时间:3月25日
3月25日,国家药监局官网公示,由礼来制药研发的巴瑞替尼片(商品名:艾乐明)中国获得上市批准,用于成人重度斑秃的系统性治疗。这也是国内一个用于系统性治疗重度斑秃的创新靶向药物。
艾乐明是一款每日口服一次的JAK抑制剂,用于系统性治疗重度斑秃的创新靶向药物,可帮助患者获得显著的毛发再生,对头发、眉毛、睫毛等区域具有持续性的改善作用。
药品名称:甲氨蝶呤注射液
研发企业:medac公司研发/康哲药业引进
适应症:银屑病
获批时间:3月25日
3月25日,国家药监局官网公示,康哲药业申报的甲氨蝶呤注射液(预充式)上市申请已获得批准,用于治疗对常规疗法不敏感的严重、顽固、致残性银屑病。
甲氨蝶呤注射液是康哲药业引进的多种规格的小容量甲氨蝶呤注射剂,也是一款以皮下给药治疗银屑病的甲氨蝶呤药物,允许患者自行皮下给药。
药品名称:重组人II型肿瘤坏死因子受体-抗体融合蛋白注射液
研发企业:三生国健
适应症:强直性脊柱炎、类风湿关节炎、银屑病
获批时间:3月31日
3月31日,国家药监局官网公示,三生国健研发的重组人II型肿瘤坏死因子受体-抗体融合蛋白注射液(商品名:益赛普)的上市申请已获得批准。
益赛普是一款预充式益赛普水针剂(301S),用于三个适应症的治疗:1)活动性强直性脊柱炎;2)中度及重度活动性类风湿关节炎;3)18岁及以上成人中度、重度斑块状银屑病。
(责编:孙欢)












