(人民日报健康客户端记者谭琪欣)5月2日,两款国产新药出海折戟的消息引发了业界广泛关注。
当天,和黄医药和君实生物先后披露,已收到美国FDA关于旗下创新药上市申请的回复信,对外公告中,美国FDA分别驳回了君实PD-1特瑞普利单抗以及和黄医药索凡替尼的获批申请,前者被要求进行一项质控流程变更,后者被拒的理由则更“严峻”,FDA表示其“已有的临床数据不足以支持获批”。
受此消息影响,5月2日,和黄医药开盘即下跌超22%,此后保持波动下跌趋势,截至5月4日收盘,报收12.38美元/股,跌幅达19.51%。
中国本土药企今后再探“出海”路,应该怎么走?

和黄医药官网图。
国产新药再遭拒背后:单一中国数据缺乏代表性
“这个结果其实并不意外。美国药品监管FDA的监管体系并不支持单一的中国数据。”5月5日,一位不愿具名的国内创新药企负责人告诉人民日报健康客户端记者。
公开资料显示,索凡替尼是一款口服酪氨酸激酶抑制剂,在2020年12月30日已经在我国获批上市,用于治疗晚期非胰腺神经内分泌瘤患者,并于2021年6月获批第二项适应症,用于治疗晚期胰腺神经内分泌瘤。2021年,在经过医保谈判之后,索凡替尼成纳入中国医保目录。
作为我国第一个获批用于治疗NET(直肠神经内分泌肿瘤)的自主创新药,世界上第二个治疗非胰腺NET的靶向药物,索凡替尼来头并不小。2019年至2020年间,索凡替尼曾先后获得美国FDA授予孤儿药资格以及快速通道资格。2021年6月,索凡替尼在美提交的新药上市申请获得受理,这一消息曾让和黄医药的一路上扬,如今不到一年,局面已大不相同。
是什么让索凡替尼出海受阻?据和黄医药发布的公告,美国FDA给出的答复称目前基于两项成功的中国Ⅲ期实验以及一项美国桥接研究的数据包,尚不足以支持药品在美国获批。
“这一决定背后的影响因素有多重,但最主要的还是数据的问题。美国FDA极为关注的是申请方提交的创新药物临床数据,是否能够体现这一药物具有‘满足当前美国本土甚至世界范围内未被满足的临床需求’的潜力。”中山大学医药经济研究所所长宣建伟告诉记者。
这并非首次国产新药因“单一中国数据”出海被拒。今年2月,美国FDA肿瘤药物咨询委员会(ODAC)拒绝批准信达生物/礼来共同开发的PD-1单抗。ODAC认为,除了信达生物的试验缺乏临床数据多样化之外,也未能达到美国FDA的知情同意标准。
在更早之前,2021年12月,万春医药的普那布林也被卡在单一临床试验结果,根据披露的数据,普那布林87%的患者临床数据来源于中国,因此美国FDA要求其进行第二项试验。
上述创新药企负责人向记者解释,美国药监部门在审评数据时,第一道门槛是‘代表性’,即申请人提供的临床试验数据是否与当前美国病人群组情况相吻合,因此国际多中心的临床试验难以避免。其次,临床试验的设计和最终结果非常重要,在已有同类产品竞争的情况下,该药必须证明在有效性、安全性以及病人获益率上具有明显优势,对照组试验应首选当前美国的疾病标准疗法,有必要时应开展头对头试验。
“同时,在申请上市的过程中,就试验的设计以及数据的代表性合理性等问题,申请方必须时刻与药监部门保持沟通,这在申请上市的过程中是很容易被忽略但非常关键的策略。”上述创新药企负责人告诉记者。
从挫折中学习成长:差异化的创新能力是出海成功的关键
“全球化是我国创新药企在成长过程中的自然选择,但国产新药出海,不能过度依赖仿制创新及仅在中国本土市场所取得的数据以及成就,研究及申报程序要全面符合美国药品监管的体系要求,意味着创新企业要大量地投入到临床研究中。”宣建伟认为,最终是否能成功,指向的则是一个我国创新药企无法回避的问题:是否具备产品综合价值差异化的创新能力。
事实上,我国创新药不乏出海成功的样本。2019 年11月,百济神州研发的首个国产BTK 抑制剂泽布替尼获美国FDA 批准上市,实现中国本土原研抗癌新药出海“零的突破”,这一消息一度让医药圈为之沸腾。两年后,2022年2月,传奇生物宣布其原创CAR-T产品在美获批的消息再度刷屏医药圈,消息公布后,传奇生物在纳斯达克的股价大涨超过12%。
记者查询公司公告发现,泽布替尼的首次获批基于两项临床试验的有效性数据,分别为中国开展的单臂Ⅱ期临床研究BGB-3111-206,以及在澳大利亚开展的全球Ⅰ/Ⅱ期临床试验BGB-3111-AU-003,值得注意的是,BGB-3111-206队列中复发难治套细胞淋巴瘤患者的完全缓解率数值达到59%,高于当时已上市的BTK抑制剂伊布替尼或阿卡替尼。支持传奇生物的CAR-T产品最终获批的则是一项1b/II期国际多中心试验,经临床多重治疗后的复发及难治性多发性骨髓瘤患者接受了CAR-T输注,最终结果显示,疾病总缓解率、完全缓解率分别为98%、83%。
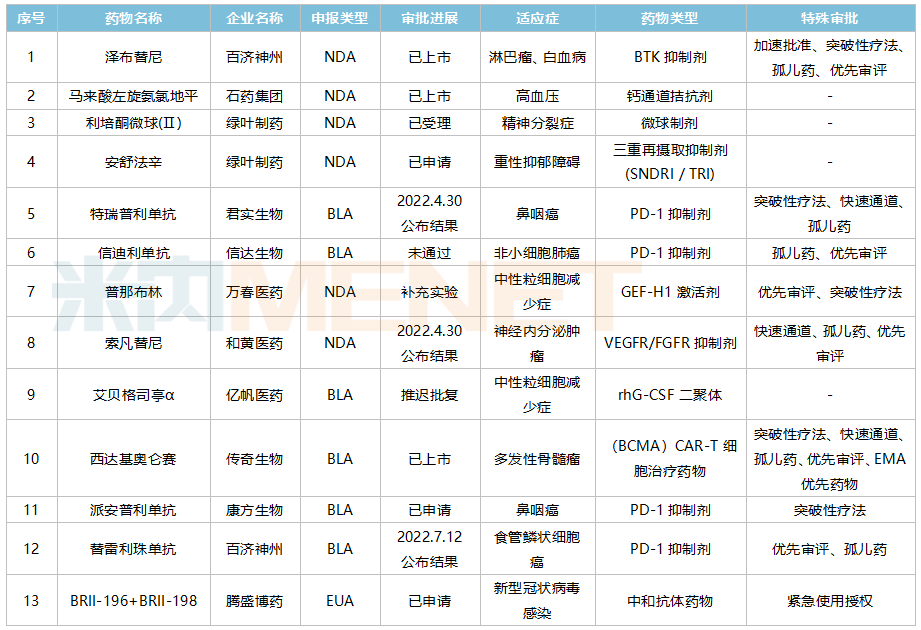
米内网图。
根据米内网数据统计,目前至少有13款国产新药向美国FDA提交了上市申请。在接下来的出海之旅中,百济神州及康方生物旗下的两款PD-1产品备受关注,两款PD-1上市申请已获受理,且根据百济神州公告,其PD-1产品上市申请结果预计会在今年7月11日公布。
排着队拿着“出海”号码牌的国产创新药企们会迎来怎样的结局?上述创新药企负责人告诉记者,随着科学技术的发展,医药创新的水平水涨船高,美国FDA的药品监管规则也在不断调整收紧中,但监管的最终目标始终未变,即如何将有效的资源留给能填补临床空白的创新,药企要做的是努力找到与监管目标的交集,欲速则不达,不一样的选择,一定会带来不一样的命运。
根据和黄医药的公告,和黄医药将积极与美国当局保持合作以评估其反馈意见,继续推动索凡替尼的上市申请;另据君实生物公告,预计今天夏天会重新提交上市申请。
“中国新药出海道阻且长,行则将至。个人不认为现在的暂时受挫会演变成为一个恶性循环,反而认为,无论是国内创新药企业还是资本都会从‘失败’中学习成长。在以往的经验中,无论是药企还是资本都会更青睐‘me-too’的快速跟进产品而容易放弃需长期投入具更高风险的‘first-in-class’及能填补临床未满足需求的产品,但我相信,经过这些挫折之后,二者都会变得更加冷静以及目光长远,创新药品以及创新药企的大浪淘沙难以避免。”宣建伟说。
(责编:荆雪涛)












