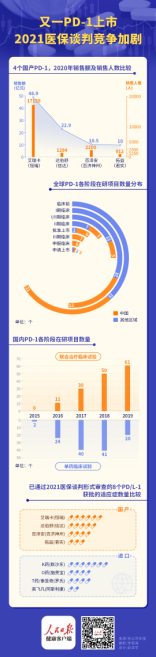
截至8月7日,健康时报记者根据国家药监局药品审评中心数据梳理统计发现,截至目前,已经有9个PD-1/PD-L1单抗产品在中国获批上市,其中中国生物制药派安普利单抗、恒瑞医药卡瑞利珠单抗、百济神州替雷利珠单抗、君实生物特瑞普利单抗、信达生物信迪利单抗,这5款为国产创新药。
中国生物:制药安普利单抗
8月5日,中国生物制药(1177.HK)宣布,肿瘤免疫创新药物派安普利单抗注射液(商品名:安尼可)正式获得国家药品监督管理局的批准,用于至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤成人患者的治疗。
据中国生物制药提供的材料显示,作为在中国第五个上市的同类产品,派安普利单抗是目前全球已上市药物中唯一采用IgG1亚型且经Fc段改造的新型PD-1单抗。该项注册临床研究的主要研究者、北京大学肿瘤医院淋巴瘤科主任朱军教授介绍,派安普利单抗选择结构稳定的 IgG1 亚型,可避免 IgG4 亚型 PD-1 单抗自身聚集、以及与体内抗肿瘤 IgG1 结合的问题,从而增强免疫治疗疗效。
中国生物制药董事会主席谢其润在新闻发布会上表示,派安普利是公司首个PD-1药物,中国生物制药在抗肿瘤创新药方面,不仅有小分子靶向药,也有大分子生物药,补上了产品管线的一块关键“拼图”。
恒瑞医药:卡瑞利珠单抗
2020年12月28日,国家医保局、人力资源和社会保障部公布《国家基本医疗保险、工伤保险和生育保险药品目录(2020年)》,恒瑞医药自主原研PD-1抑制剂卡瑞利珠单抗(艾瑞卡)成功进入医保目录,用于晚期肺癌、肝癌、食管癌和霍奇金淋巴瘤的治疗。
2021年6月10日,恒瑞医药(600276.SH)发布消息称,其自主研发的PD-1抑制剂卡瑞利珠单抗(商品名:艾瑞卡)正式获得国家药品监督管理局核准签发的《药品注册证书》,批准卡瑞利珠单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗。此适应证是全球第一个获批的一线鼻咽癌适应证,也是继霍奇金淋巴瘤、肝癌、肺癌、食管鳞癌、二线及以上鼻咽癌之后,卡瑞利珠单抗获批的第6个适应证。截至目前,卡瑞利珠单抗仍是获批适应证最多的国产PD-1抑制剂。
百济神州:替雷利珠单抗
2019年12月27日,百济神州自主研发的抗PD-1抗体药物百泽安(通用名:替雷利珠单抗注射液)正式通过国家药品监督管理局(NMPA)批准,用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤(R/R cHL)患者。
2021年6月22日,百济神州自主研发的PD-1单抗百泽安®(替雷利珠单抗)正式获得国家药品监督管理局(NMPA)批准联合化疗用于驱动基因阴性、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)的一线治疗。同时获批的还有肝癌适应症,至此,替雷利珠单抗共获批5个适应症。
君实生物:特瑞普利单抗
7月29日,君实生物(1877.HK,688180.SH)宣布,国家药品监督管理局(NMPA)已受理公司自主研发的抗PD-1单抗药物特瑞普利单抗联合含铂化疗一线治疗局部晚期或转移性食管鳞癌的新适应证上市申请,这也是特瑞普利单抗在中国递交的第五项上市申请。
特瑞普利单抗是中国首个批准上市的以 PD-1 为靶点的国产单抗药物,且至今已在中、美等多国开展了覆盖超过 15 个适应症的 30 多项临床研究。在国内,特瑞普利单抗已经被获批用于黑色素瘤、鼻咽癌、尿路上皮癌等适应证。
信达生物:信迪利单抗
信迪利单抗于2019年11月成功纳入中国国家医保目录,是全国首个、也是当年唯一一个进入国家医保目录的PD-1抑制剂。
6月25日,国家药监局官网显示,信达生物信迪利单抗新适应症上市申请(CXSS2100009)获批,与贝伐珠单抗(达攸同)联合用于既往未接受过系统治疗的不可切除或转移性肝细胞癌。这是信迪利单抗在非霍奇金淋巴瘤、非鳞状NSCLC、鳞状NSCLC之后获批的第4项适应症。荆雪涛整理。












