(健康时报记者 赵萌萌)7月28日,记者从国家药监局官网获悉,关于美敦力公司对植入式神经刺激电极主动召回的公告。其中该批次产品涉及在中国销售数量有3196台。
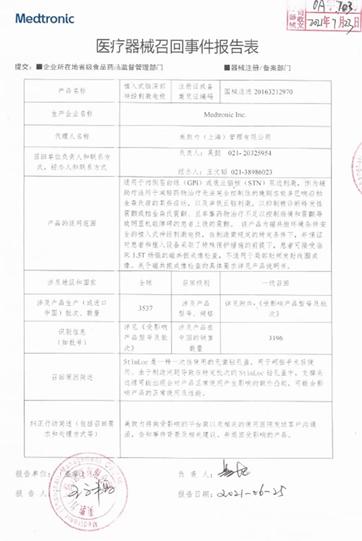
据了解,植入式脑深部神经刺激电极适用于内侧苍白球或底丘脑核双边刺激,作为辅助疗法用于减轻药物,治疗无法完全控制住的晚期左旋多巴响应帕金森病的某些症状,以及单侧丘脑刺激,以抑制被诊断特发性震颤或帕金森病震颤、且单靠药物治疗不足以控制病情和震颤导致明显机能障碍的患者上肢的震颤。
值得注意的是,美敦力公司对其生产的植入式神经刺激电极主动召回是一级召回,召回原因是因Stiml.oc是一种一次性使用的无菌钻孔盖,用于颅脑手术后使用。由于制造问题导致在特定批次的StimLoe钻孔盖中,支撑夹边缘可能出现会对产品正常使用产生影响的额外凸起,可能会影响产品的正常使用及性能。
根据原国家食品药品监督管理总局下发的《医疗器械召回管理办法》(自2017年5月1日起),明确规定三级召回为使用该医疗器械引起危害的可能性较小但仍需要召回的;一级召回为使用该医疗器械可能或者已经引起严重健康危害的。
公开资料显示,美国美敦力公司成立于1949年,据Medical Design and Outsourcing发布的《2020年全球医疗器械企业100强》,美敦力排第1位,财年销售额达到289.13亿美元;此外,美敦力研发投入达23.31亿美元,也排第1位。
此次美敦力实施一级召回并非今年首次。健康时报记者梳理国家药品监督管理局网站发布的相关公告发现,从2021年1月至今,美敦力的主动一级召回事件2021年1月至今已发生3起。二级召回3起,三级召回2起,共计8起。
2021年7月6日,美敦力公司也对公司旗下产品覆膜支架系统也宣布一级召回,其原因是因存在产品在开放手术期间内,造成两名患者的死亡。
某医疗器械公司的质量负责人曾在接受健康时报记者采访时表示,医疗器械召回制度实际上已经是国际上非常成熟的管理存在隐患的医疗器械的有效模式,医械产品有它的特殊性,生产工艺很复杂,不可避免会出现瑕疵产品。发现问题后主动召回是负责任的表现,降低医疗器械在使用中的风险。













网友评论