11月6日(周五),美国食品和药品监督管理局(FDA)召集的咨询委员会将讨论渤健和卫材公司的用于治疗早期阿尔茨海默病患者的aducanumab生物制品许可申请,并投票决定是否向FDA推荐批准这款创新疗法。

渤健官网披露了这一消息
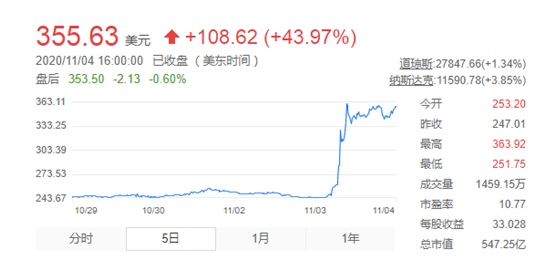
而在此之前,美东时间11月4日(周三),FDA在官网上公布了咨询委员会提供的背景资料,其中显示了不同FDA审评员对这一BLA的评估。该机构指出,渤健的实验性AD药物被证明有效,增加了其迅速获得批准的机会。受该消息影响,当日该公司股价盘中曾一度上涨超42%至353美元,几乎是近期日均交易量的8倍。
《世界阿尔茨海默病2018年报告》显示,每3秒钟,全球就有一位痴呆症患者产生。全球目前至少有5000万的痴呆患者。到了2050年,这个数字预计将达到1.52亿。其中,有约60%-70%为阿尔茨海默病患者。然而与逐渐增加的患病人数相反,作为一种神经退行性疾病,阿尔茨海默病患者目前无法治愈,甚至治疗药物也相对缺乏。
多年来各大制药巨头在阿尔茨海默病的研发上都有失败经历。2013年,辉瑞放弃了抗体bapineuzumab的研发;2016年底,礼来的solanezumab在第三阶段试验中未能超过安慰剂的疗效;2017年初,默克承认BACE抑制剂verubecestat“几乎没有发挥作用”,遂取消二次尝试;强生公司针对BACE抑制剂atabecestat的试验也于2018年5月被搁置……
自2003年至今17年,FDA尚未批准任何治疗AD的新药。
而aducanumab的研发也历尽波折,2019年3月,由于中期无效性分析(futility analysis)认为这款抗体达到预期疗效的可能性很小。渤健和卫材公司宣布停止aducanumab的3期临床试验,然而在去年10月,两家公司宣布,对3期临床试验的最终分析显示,aducanumab能够显著降低AD患者认知能力衰退的速度。基于这些发现,渤健向FDA递交了aducanumab的生物制品许可申请,并且获得了FDA授予的优先审评资格。
尽管目前仍然有部分专家学者对aducanumab的数据产生质疑,但投资界人士对于aducanumab的获批表示乐观。而FDA将在明年3月对是否批准该药物做出最终决定。
(运营:韦川南)













网友评论