(健康时报记者 赵萌萌)据健康时报记者不完全统计,截至2021年12月28日,至少31款新药(不包含疫苗和中药)通过优先审评获批上市。据了解,优先审评审批程序适用于临床急需的短缺药品、防治重大传染病和罕见病的新药;儿童用药新品种、剂型和规格;急需的疫苗和创新疫苗等。
从获批产品治疗领域来看,肿瘤和罕见病是产品获批数量最多的两大领域。其中13个肿瘤新药获批上市,覆盖非小细胞肺癌、大B细胞淋巴瘤、乳腺癌、肝细胞癌、胃癌、卵巢癌、输卵管癌或原发性腹膜癌、基底细胞癌等。
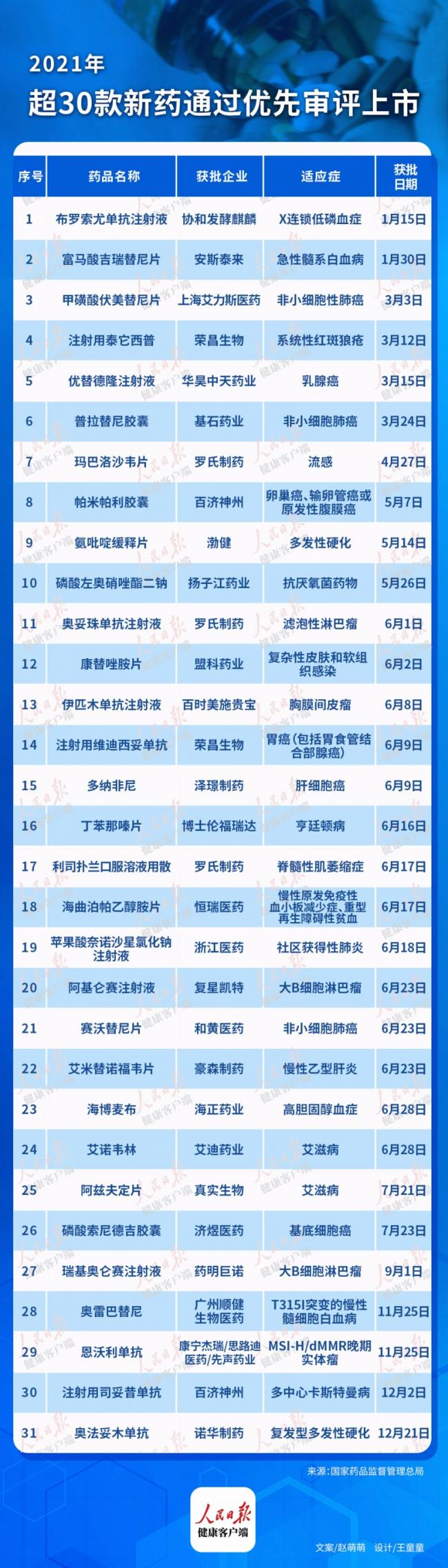
在肿瘤领域,2021年的中国市场收获了几款意义重大的药物。
2021年6月,复星凯特的阿基仑赛注射液获批,我国迎来首款CAR-T细胞治疗产品。无独有偶,在紧接着的9月1日,药明巨诺的瑞基奥仑赛注射液获批上市,成为我国第二款获批上市的CAR-T细胞治疗产品,也是国内首款1类生物制品的CAR-T产品。
同样在6月,荣昌生物自研注射用维迪西妥单抗获批上市,值得注意的是,维迪西妥单抗是我国自主研发的首个抗体偶联药物,不同于国外同类药物,维迪西妥单抗具有差异化的生物特性,有更好的靶向性和疗效性,以及更好的耐药性。
8月,荣昌生物与国际知名生物制药公司西雅图基因达成一项合作,后者获得荣昌生物ADC新药维迪西妥单抗大部分海外市场的开发和商业化权益,作价26亿美元,刷新中国药企单品种海外授权交易记录。
据健康时报记者不完全统计,在罕见病领域,今年以来,我国获批上市的罕见病新药共有10个,包括协和发酵麒麟的布罗索尤单抗、武田的醋酸艾替班特和维拉苷酶α、杨森的富马酸二甲酯、渤健的氨吡啶、罗氏的利司扑兰口服溶液用散和萨特利珠单抗及百济神州引进的司妥昔单抗等。
其中共有5款罕见病新药通过优先审评获批上市。2021年1月,日本药企协和麒麟公司的布罗索尤单抗注射液获批上市,布罗索尤单抗注射液是第一个被批准治疗X连锁低磷血症的药物,填补了该治疗领域无药可用的空白,同时该药被列入“第二批临床急需境外新药名单”。
同年12月,通过优先审评审批程序批准药品注射用司妥昔单抗的进口注册申请,该药因罕见病用药被纳入《第一批临床急需境外新药》名单,由百济神州引进,并于2021年1月递交上市申请获受理。
从上述获批情况来看,罕见病药物主要还是依靠海外引进。不过,随着鼓励政策不断出台,近些年来布局罕见病领域的企业在逐步增多。
(运营:)

